Gli orbitali atomici
Gli elettroni sono distribuiti attorno al nucleo degli atomi seguendo le leggi della Meccanica quantistica, in alcune aree chiamate orbitali atomici. È l’argomento di oggi.
Per il resto parleremo di una novità riguardante le onde gravitazionali, dei famosi punti luminosi di Ceres – il pianeta nano – e di altre notizie della settimana.
Di cosa parliamo oggi
– la funzione d’onda
– come è fatto un atomo?
– gli orbitali atomici
– pillole della settimana
La funzione d’onda
Parlando della Meccanica quantistica avevamo detto che non è possibile misurare contemporaneamente la posizione e la velocità delle particelle con precisione arbitraria. Meglio misuriamo la posizione di una particella, più incerta è la misura della sua velocità e viceversa. Non è un limite sperimentale, ma un confine dato alla nostra conoscenza dalla natura e viene chiamato principio di indeterminazione di Heisenberg (per chi si è perso e per chi non c’era, ne abbiamo parlato qui). Per questo in Meccanica quantistica viene usata una descrizione probabilistica dello stato fisico delle particelle: la funzione d’onda. La funzione d’onda ci dice qual è la probabilità di trovare una certa particella in un determinato stato fisico – ad esempio qual è la probabilità di trovarla in una certa posizione. Questa descrizione probabilistica del comportamento delle particelle ha avuto molto successo, anche se ci ha costretto a cambiare modo di pensare. Se mettiamo una pallina sul tavolo e usciamo dalla stanza, possiamo dire con certezza che la pallina è rimasta sul tavolo. Se poi la lanciamo per aria, possiamo calcolare il suo moto e predire con esattezza dove cadrà. Con le particelle non funziona così: non possiamo più dire, prima di effettuare una misura, dove è una particella, né possiamo sapere in anticipo quale sarà la sua traiettoria. Possiamo solo conoscere la probabilità di misurarla in un punto a una certa velocità.
Come è fatto un atomo?
La funzione d’onda è lo strumento giusto per studiare la struttura degli atomi. Prima però chiariamoci le idee: cos’è un atomo? Prima che fossero scoperte le particelle elementari si credeva che la materia fosse costituita da piccoli granelli chiamati atomi (àtomos = indivisibile). È effettivamente così. La materia è composta di atomi che differiscono tra loro per dimensione, forma e altre proprietà fisiche e che possono combinarsi per creare molecole e dunque diversi materiali. Però non sono veramente indivisibili, anzi. Un atomo è formato da tre tipi di particelle: protoni, neutroni e elettroni. I protoni hanno carica elettrica positiva, i neutroni non hanno carica elettrica e gli elettroni – che sono 1836 volte più leggeri dei protoni e molto più piccoli – hanno carica elettrica negativa. Agli inizi del Novecento i fisici credevano che i protoni (rossi, in figura) se ne stessero insieme ai neutroni (verdi) a formare il nucleo atomico – la parte centrale dell’atomo – e che gli elettroni (gialli) ruotassero intorno al nucleo un po’ come i pianeti ruotano attorno al Sole.
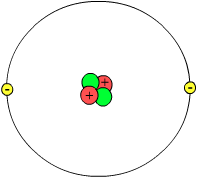
(Credit: Wikimedia Commons, CC BY-SA 3.0)
Questo schema non nasce a caso – la legge di Coulomb che regola l’attrazione tra cariche elettriche negative e positive è molto simile alla legge di gravitazione universale di Newton, che modella l’attrazione dei corpi celesti – e ha permesso di spiegare come è formata la materia.
Atomi con un numero equivalente di protoni, neutroni e elettroni sono atomi dello stesso elemento. Ad esempio gli atomi composti da 3 protoni, 4 neutroni e 3 elettroni sono atomi di litio, quella sostanza usata nelle batterie. Solitamente protoni e elettroni sono presenti nell’atomo in numero uguale e cambiando il numero di protoni, cambia l’elemento: l’idrogeno ha 1 protone, l’elio ne ha 2, con 8 si fa l’ossigeno, con 26 il ferro e così via. Cambiando il numero dei neutroni invece si formano i cosiddetti isotopi, ossia atomi dello stesso elemento ma con caratteristiche fisiche un po’ diverse. Per dire, il trizio è un isotopo dell’idrogeno che si ottiene aggiungendo due neutroni al nucleo dell’idrogeno. Ed è radioattivo.
Tuttavia i fisici hanno scoperto che gli atomi non possono essere fatti come un piccolo sistema solare – con il nucleo al centro e gli elettroni che orbitano intorno. Le leggi dell’elettromagnetismo di Maxwell infatti dicono che delle cariche elettriche che si muovono emettono energia sotto forma di onde elettromagnetiche. Gli elettroni quindi, ruotando come piccoli pianeti, dovrebbero emettere onde elettromagnetiche, perdere energia e, prima o poi, cadere sul nucleo atomico distruggendo l’atomo. Perché non accade?
Gli orbitali atomici
Non accade perché gli elettroni sono particelle che obbediscono alle leggi della Meccanica quantistica e non seguono una traiettoria come l’orbita circolare disegnata sopra. Se seguissero una traiettoria precisa, esisterebbe una formula matematica che predice dove si trova ogni elettrone e a che velocità sta viaggiando. Pensateci: studiando le orbite dei pianeti intorno al Sole, o dei satelliti attorno alla Terra, siamo in grado di calcolare dove si trovano e la loro velocità. Sappiamo però che, a causa del principio di indeterminazione di Heisenberg, non è possibile fare lo stesso per le particelle. L’idea stessa di orbita, quindi, non si può applicare al modello atomico: gli elettroni non seguono delle orbite ruotando attorno ai protoni e ai neutroni.
Eppure gli esperimenti hanno dimostrato che l’atomo è formato da due regioni, una più centrale e densa, fatta di protoni e neutroni, e una più esterna e diradata, in cui si trovano gli elettroni.
Per riuscire a descrivere questa struttura possiamo provare a studiare la funzione d’onda degli elettroni che si trovano attorno al nucleo, individuando quelle zone in cui è più probabile trovare gli elettroni, quando li cerchiamo. Le zone adiacenti al nucleo in cui è più probabile trovare gli elettroni sono chiamate orbitali atomici. Si chiamano così perché sostituiscono l’idea di orbita – non più utilizzabile.
L’orbitale dell’atomo più piccolo – l’idrogeno, che ha 1 protone, 1 elettrone e zero neutroni – è molto semplice: è una sfera che avvolge il nucleo atomico
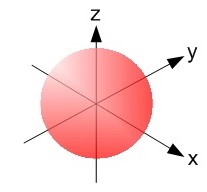
(Credit: Av haade – Own work, CC BY-SA 3.0)
e ci dice che in quella zona è c’è un alta probabilità di trovare l’elettrone dell’idrogeno. Per convenzione gli orbitali sono quelle aree in cui la probabilità di trovare l’elettrone è superiore al 95%. Significa quindi che l’elettrone potrebbe trovarsi anche fuori da quella zona, ma con una probabilità sempre più bassa man mano che ci si allontana.
L’idrogeno però ha una struttura molto semplice, perché ha un solo elettrone che ruota attorno a un protone.
Come si dispongono gli elettroni, quando sono più di uno?
Il principio di esclusione di Pauli
Le particelle, oltre ad avere una posizione, una velocità o una carica elettrica, possono avere anche altre proprietà fisiche. Una di queste è chiamata spin. Non ne parliamo oggi, perché è una cosa piuttosto complicata da spiegare, ma è importante citarlo perché anche gli elettroni hanno uno spin, che può assumere due valori: +1/2 o -1/2 (Non fate caso ai numeri o al loro significato). La cosa importante da sapere è che due elettroni con lo stesso spin non possono stare nello stesso orbitale. È una legge dettata dalla natura, conosciuta come principio di esclusione di Pauli: se in un orbitale c’è un elettrone con spin +1/2 e ce ne è un altro, quest’altro ha per forza spin -1/2. Quindi in un orbitale ci possono essere al massimo due elettroni.
Se attorno a un atomo ci sono più di due elettroni, questi si trovano per forza in orbitali diversi.
Esistono infatti molti tipi di orbitali, che vengono riempiti dagli elettroni seguendo un ordine particolare. I primi orbitali hanno queste forme strane.
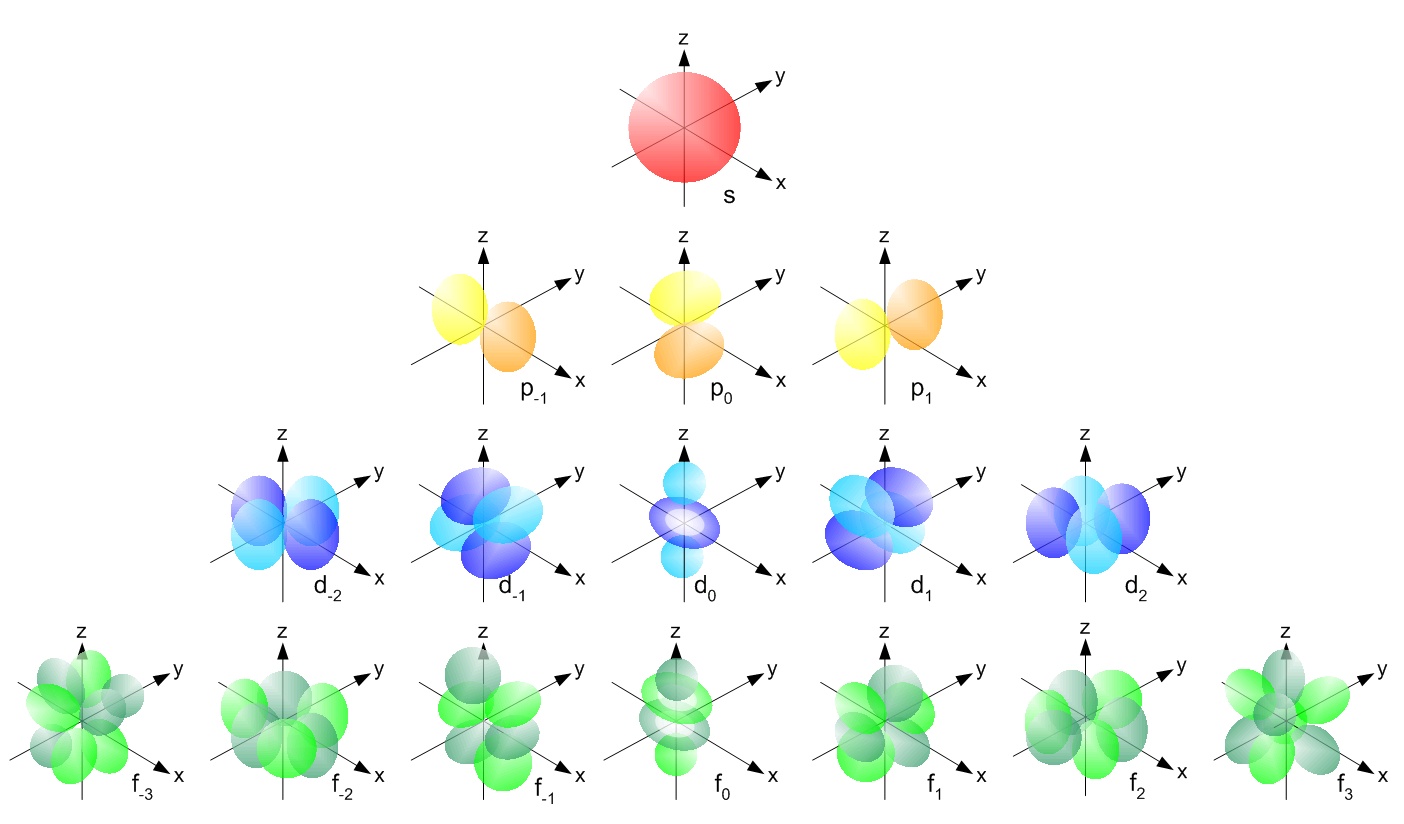
(Credit: Av haade – Own work, based on various sources, sketch NOT computer generated models, CC BY-SA 3.0)
Il primo orbitale a riempirsi è quello rosso, chiamato orbitale s, poi si riempiono gli orbitali gialli, detti p, poi quelli azzurri e così via. Per chi volesse approfondire la struttura atomica, gli orbitali e scoprire cosa sono i livelli energetici, lascio un link negli approfondimenti.
I legami chimici
Una cosa importante degli orbitali è che questi giocano un ruolo di primo piano nella formazione dei legami chimici tra gli atomi. Gli orbitali più esterni di due atomi, infatti, possono legarsi tra loro, mettendo in comune i loro elettroni. In questo caso nascono dei nuovi tipi di orbitali, chiamati orbitali molecolari. Non entriamo nel dettaglio. Chi è appassionato di chimica, trova un link negli approfondimenti.
Pillole della settimana
Alcune notizie di questi giorni, brevi.
Uno strano segnale forse proveniente dai buchi neri
Il 14 Settembre 2015, il Fermi Telescope della NASA ha misurato un lieve segnale proveniente dalla stessa regione di spazio da cui proveniva l’onda gravitazionale misurata da LIGO. Si tratta di un’emissione di raggi gamma ed è stata misurata meno di mezzo secondo dopo la rivelazione di LIGO. Potrebbe trattarsi di una coincidenza, anche se le probabilità che due segnali così importanti arrivino in un tempo così ravvicinato per puro caso è inferiore allo 0.2%. Nel breve video qui sotto è stata ricostruita la regione da cui provengono i due segnali. Questa misurazione potrebbe permetterci di capire meglio come funziona la fusione tra due buchi neri, ma soprattutto ci dimostra quanto è importante la triangolazione dei segnali. Per individuare l’esatta posizione di una sorgente di onde gravitazionali bisogna effettuare una triangolazione. Per fare una triangolazione servono tre “antenne”. Oggi ne abbiamo due – i due LIGO negli Stati Uniti. Quando anche Virgo, il rivelatore italiano, sarà attivo, sarà possibile localizzare nel giro di alcuni minuti l’origine delle onde gravitazionali e puntare tutti gli altri telescopi verso quel punto, per misurare altri tipi di radiazioni.
I punti luminosi di Ceres
La sonda Dawn, lanciata dalla NASA per raggiungere il pianeta nano Ceres e l’asteroide Vesta aveva individuato su Ceres dei punti molto luminosi, forse composti di ghiaccio esposto alla luce del sole. Non abbiamo ancora una risposta definitiva, ma nel frattempo abbiamo immagini di qualità sempre migliore, come questa immagine del cratere Haulani, ripreso da un’altitudine di 1470 km (i colori di questa foto non sono reali, ma evidenziano materiali di origine diversa. Si ingrandisce cliccando).

(Credit: Dawn/NASA)
Installato il modulo BEAM
Dopo essere stato lanciato con il Falcon 9, il modulo gonfiabile BEAM è stato installato con successo sulla Stazione Spaziale Internazionale. Il video dell’installazione si trova qui.
Analizzata della polvere interstellare
La sonda Cassini, realizzata dalla NASA con la collaborazione dell’Agenzia Spaziale Italiana, si trova in orbita intorno a Saturno. Cassini è dotata di uno strumento chiamato Cosmic Dust Analyzer, in grado di analizzare minuscoli granelli di polvere spaziale. Queste analisi hanno individuato per la prima volta delle polveri provenienti dall’esterno del Sistema Solare. Tutti i dettagli qui.
Feedback
Se vi piace la newsletter potete inoltrarla a un amico o suggerirgli di iscriversi.
Per scrivermi, mandate una mail a spacebreak [at] francescobussola.it
Per approfondire
– Il modello atomico a orbitali, spiegato con qualche dettaglio in più
– Gli orbitali molecolari
Cos’è la Meccanica quantistica
Abbiamo detto tempo fa che in fisica esistono oggi due grandi teorie comunemente considerate “vere”, perché in grado di descrivere una grande varietà di fenomeni fisici in maniera precisa e coerente: la Teoria della Relatività e la Meccanica quantistica. Della Relatività abbiamo già parlato nelle scorse newsletter – qui e qui. Di essa sappiamo che descrive bene il comportamento dei corpi e della materia ad alte energie: ci permette di studiare il moto di pianeti e stelle, di lanciare satelliti e navicelle spaziali, di comprendere il funzionamento dell’universo. È arrivata addirittura a predire, con sessant’anni di anticipo, l’esistenza delle onde gravitazionali.
Eppure ci sono ambiti dove la Relatività fallisce: se si studiano i processi nucleari o subnucleari, il comportamento microscopico delle molecole, le interazioni tra le particelle, la struttura della materia, la Relatività è muta. A queste scale entra in gioco la Meccanica quantistica.
Di cosa parliamo
– che cos’è la Meccanica quantistica
– alcuni esempi (già fatti)
– cosa dice la Meccanica quantistica
– cose che la Meccanica quantistica sa
– il problemone
– domande e risposte
– pillole della settimana
Cos’è la Meccanica Quantistica
La Meccanica quantistica è una teoria dell’infinitamente piccolo. Ancora una volta, come è accaduto con la Relatività, dovremo abbandonare molti pregiudizi per apprezzarla, perché la natura non si comporta come ci aspettiamo: esplorando il mondo microscopico – o a scale inferiori – si osservano fenomeni bizzarri che non sono spiegabili dal senso comune, né dalla Meccanica di Newton, che studiava la materia come se fosse fatta di piccole palline che si scontrano. Come vedremo, le particelle che compongono la materia non si comportano per niente come palline. Non sempre, almeno.
Perché “quantistica”
L’aggettivo quantistica, come abbiamo già visto, deriva dalla parola quanto. Ci si era accorti studiando l’effetto fotoelettrico (ci arriviamo) che l’energia non viene trasmessa in maniera continua da un corpo a un altro, ma attraverso dei piccoli pacchetti energetici. A questi pacchetti venne dato il nome di quanti. I primi quanti scoperti furono i quanti di luce, ossia i fotoni, che sono quindi pacchetti di energia elettromagnetica. Ritornando al discorso di prima, questi fotoni a volte si comportano come delle palline, altre volte no.
Alcuni esempi (già fatti)
In che senso le particelle, come ad esempio i fotoni, non si comportano come piccole palline? Un esempio che abbiamo già incontrato è quello di un elettrone che si dirige verso una doppia fenditura. Ne abbiamo parlato un paio di settimane fa.
Riassumendo. Se spariamo un elettrone contro due fenditure molto vicine, la Meccanica di Newton ci dice – così come il nostro intuito – che l’elettrone sceglierà di passare o in una fenditura o nell’altra. Un po’ come una pallina che cade nel flipper, che a volte passa a sinistra di ostacolo, a volte a destra con una probabilità del 50%. Sparando tanti elettroni verso le fenditure ci aspettiamo quindi che metà degli elettroni passino dalla fenditura di sinistra, metà da quella di destra, raccogliendosi in due punti su una lastra fotografica posta oltre le fenditure.
Come abbiamo visto, non funziona così: gli elettroni, anche se sparati uno alla volta, si dispongono oltre le fenditure creando una figura di interferenza. Come detto l’altra volta, l’unico modo per interpretare questo fenomeno è accettare che in questo caso gli elettroni – e in generale le particelle – non si comportino come palline, ma come onde. Arrivati alle fenditure, le attraversano entrambe contemporaneamente, un po’ come un’onda del mare che passa da due boccaporti vicini.
L’esperimento della doppia fenditura non è l’unico caso in cui la natura si comporta in modo bizzarro. Altri fenomeni, come il famoso effetto fotoelettrico, scoperto nel 1887, non erano spiegabili dalla Meccanica di Newton o dall’elettromagnetismo di Maxwell. Anche stavolta trovate tutto qui.
Cosa dice la Meccanica quantistica
Se le particelle a volte si comportano come onde, allora la Meccanica di Newton non va bene per descriverle. Serve una nuova Meccanica che tenga conto del loro comportamento anomalo, ossia servono delle nuove leggi fisiche.
Chiaramente non posso insegnarvi la Meccanica quantistica. Avreste bisogno di conoscenze matematiche avanzate e mesi di studio. Però possiamo elencare quali sono i principi cardine di questa teoria, tentando di capirne il significato in maniera un po’ rozza. Per qualsiasi dubbio, scrivetemi.
La dualità onda particella
Della dualità onda particella abbiamo già parlato. La Meccanica quantistica afferma che tutte le particelle – e quindi tutti i corpi, – in determinate circostanze si comportano come onde. È la famosa legge di De Broglie, che però ci dice anche che non è tecnologicamente possibile osservare la natura ondulatoria dei grandi corpi (grandi quanto? Eh, questo è un problemone. Ci torniamo). Però ci riusciamo per corpi piccoli, come ad esempio gli elettroni.
Il principio di indeterminazione di Heisenberg
Il principio di indeterminazione di Heisenberg dice che non è possibile conoscere con precisione arbitraria la posizione e la velocità di una particella. È una questione molto complicata, che ha lasciato perplessi i fisici per molto tempo e che riguarda il concetto di misura. Se si misura con alta precisione la posizione di una particella, non si è più in grado di determinare la sua velocità e viceversa. Ad esempio se volessimo sapere con precisione qual è la posizione di un elettrone dovremmo provare a colpirlo con un fotone ad alta energia. Durante l’urto, però, l’energia viene trasferita all’elettrone e ne perturba la sua velocità, che quindi non possiamo misurare con precisione.
L’esempio che vi ho fatto è un po’ rozzo, ma rende l’idea delle difficoltà che si incontrano quando si vuole studiare la natura nel piccolo (sì, ma quanto piccolo? È il problemone di prima). Siamo abituati a misurare le quantità fisiche usando degli oggetti (un metro, un termometro, …) e generalmente questi oggetti non disturbano il sistema che stiamo misurando. Quando si studia l’infinitamente piccolo diventa più difficile capire cosa significa “misurare” e, soprattutto, l’atto di misura può influenzare sensibilmente il sistema che stiamo studiando.
Vale la pena dire che il principio di Heisenberg è un po’ più generale di come l’ho presentato qui sopra e che, nelle formulazioni moderne della Meccanica quantistica, è un teorema e può essere quindi dimostrato.
La funzione d’onda
Siccome non possiamo misurare con qualsiasi precisione alcune proprietà delle particelle – come la posizione e la velocità – siamo costretti a cambiare approccio: se non possiamo dire “la particella è qui e viaggia a questa velocità”, possiamo però dire qual è la probabilità di trovare una particella in una certa posizione o a una certa velocità. Questa descrizione probabilistica dello stato fisico di una particella è chiamata funzione d’onda. Ad esempio nel caso dell’esperimento della doppia fenditura, la funzione d’onda ci dice che la probabilità che la particella passi nella fenditura di sinistra è il 50% – che è un modo un po’ meno rozzo di dire che la particella passa da entrambe le fenditure. Chiaramente quello che adesso sembra solo un gioco di parole ha in realtà un preciso significato matematico, che però non indaghiamo oltre. Ci basta sapere una cosa: questa idea della funzione d’onda ha risolto parecchi problemi.
Cose che la Meccanica quantistica sa
Senza addentrarci nella fisica delle particelle, o in effetti quantistici esotici come l’entaglement (ne parleremo), la Meccanica quantistica è in grado di spiegare una quantità enorme di fenomeni. Dal funzionamento delle chiavette USB alla risonanza magnetica, questa Teoria ha trovato infinite applicazioni tecnologiche. Pensate che tutta la chimica moderna si basa sui principi della Meccanica quantistica, lo studio delle funzioni d’onda e di come queste cambiano quando si formano i legami chimici.
Il problemone
Nel corso della newsletter abbiamo visto che la Meccanica quantistica funziona nel piccolo, ma non nel grande. Ma piccolo quanto? Purtroppo non esiste ancora un modo per definire con precisione il limite di validità della Teoria. Questo, capirete anche voi, è un problema sia dal punto di vista pratico che da quello concettuale. Quando va usata la Meccanica quantistica e quando la possiamo approssimare usando le formule della Relatività? E se non riusciamo a capire dove inizia e dove finisce, non è che ci sfugge qualcosa?
I fisici da anni stanno provando a rispondere a queste domande, nel tentativo di trovare una teoria unica che inglobi la Meccanica quantistica e la Teoria della Relatività di Einstein, ma ancora non ci sono riusciti.
Domande e risposte
Alcune domande che mi avete fatto e alcune risposte.
Perché c’è tutto questo clamore per Samantha Cristoforetti? Che ha di speciale?
Samantha Cristoforetti è stata la prima donna italiana selezionata dall’Agenzia Spaziale Europea come astronauta. Questo forse basta a giustificare il grande interesse che ha suscitato, ma certo non spiega l’enorme copertura mediatica. Samantha, oltre ad avere i suoi account social come gli altri astronauti, ha cogestito un blog sulla sua missione, effettuato molti collegamenti tv, risposto alle domande degli appassionati. Era inoltre disponibile una webapp (Friends in space) per salutare Samantha al passaggio della ISS e da cui lei poteva rispondere con un click. E poi, ovviamente, è stato fatto il docufilm Astrosamantha.
Il tutto rientra in un progetto per spronare quelle ragazze che potrebbero intraprendere una carriera scientifica, ma non lo fanno perché sono senza un modello di riferimento. Chi meglio di Samantha, ingegnere, pilota, astronauta, poteva fare da testimonial per una campagna di questo tipo?
Hai detto che la cometa Catalina sta attraversando il Sistema solare e non tornerà mai più. Dove andrà a finire?
Continuerà probabilmente a vagare nello spazio. La sua orbita l’ha portata fuori dal Sistema solare. Forse si scontrerà con qualche altro oggetto celeste – magari un giorno verrà attirata da una stella diversa dal Sole – ma se accadrà non sarà tanto presto. Lo spazio è piuttosto vuoto.
A cosa serve la pura osservazione di fenomeni fisici, come quella delle onde gravitazionali, se non porta innovazioni tecnologiche?
È vero, la scoperta delle onde gravitazionali non ha una ricaduta tecnologica diretta, ma ci sono già molte ricadute tecnologiche indirette: per arrivare a compiere quegli esperimenti sono stati sviluppati sistemi di ultra vuoto, laser ad altissima coerenza, camere di risonanza a elevato rendimento, materiali innovativi e unici nel loro genere. Senza contare lo sviluppo di complicati modelli di analisi numerica, che potranno essere utilizzati anche in altri ambiti, un giorno. Inoltre, come ogni scoperta, non sappiamo dove ci porterà. L’osservazione delle onde gravitazionali ci permetterà di studiare una parte di universo che fino ad oggi era rimasta nascosta e non sappiamo quali conseguenze avranno questi studi. Ci possono volere anni, decenni, forse secoli, ma la conoscenza porta sempre al progresso tecnologico, prima o poi.
Pillole della settimana
Alcune notizie di questi giorni, brevi.
L’equinozio di primavera, un giorno prima
Quest’anno l’equinozio di primavera è arrivato il 20 Marzo, non il 21. C’entrano i moti millenari della Terra e il modo in cui calcoliamo il calendario. Non mi dilungo: hanno detto tutto su Gravità Zero.
ISS: c’è chi viene e c’è chi va
Dopo il rientro di Scott Kelly, Mikhail Kornienko e Sergey Volkov, è partita la Expedition 47 verso la ISS con gli astronauti Jeff Williams, Oleg Skripochka e Alexey Ovchinin. Qui il video.
Per approfondire
– La Meccanica quantistica, raccontata da Roberto Battiston, presidente dell’ASI (video)
– Una rassegna di articoli sulla Meccanica quantistica, che integrano quello che vi ho detto (EDIT: mi chiedono che avvallo i contenuti del sito linkato che parlano di olismo e medicina non convenzionale. No, ma gli articoli di Antonella Ravizza – come quello che ho linkato – sono prettamente scientifici)
– Quark, con i disegnini. Che bello che era (video breve)
– La differenza tra la Meccanica quantistica e la Meccanica classica, spiegata da Carlo Rubbia (video)