Cookie e privacy policy | 2016-2020 CC BY-NC 4.0 copyright
Gli orbitali atomici
24 Aprile 2016
Gli elettroni sono distribuiti attorno al nucleo degli atomi seguendo le leggi della Meccanica quantistica, in alcune aree chiamate orbitali atomici. È l’argomento di oggi.
Per il resto parleremo di una novità riguardante le onde gravitazionali, dei famosi punti luminosi di Ceres – il pianeta nano – e di altre notizie della settimana.
Di cosa parliamo oggi
– la funzione d’onda
– come è fatto un atomo?
– gli orbitali atomici
– pillole della settimana
La funzione d’onda
Parlando della Meccanica quantistica avevamo detto che non è possibile misurare contemporaneamente la posizione e la velocità delle particelle con precisione arbitraria. Meglio misuriamo la posizione di una particella, più incerta è la misura della sua velocità e viceversa. Non è un limite sperimentale, ma un confine dato alla nostra conoscenza dalla natura e viene chiamato principio di indeterminazione di Heisenberg (per chi si è perso e per chi non c’era, ne abbiamo parlato qui). Per questo in Meccanica quantistica viene usata una descrizione probabilistica dello stato fisico delle particelle: la funzione d’onda. La funzione d’onda ci dice qual è la probabilità di trovare una certa particella in un determinato stato fisico – ad esempio qual è la probabilità di trovarla in una certa posizione. Questa descrizione probabilistica del comportamento delle particelle ha avuto molto successo, anche se ci ha costretto a cambiare modo di pensare. Se mettiamo una pallina sul tavolo e usciamo dalla stanza, possiamo dire con certezza che la pallina è rimasta sul tavolo. Se poi la lanciamo per aria, possiamo calcolare il suo moto e predire con esattezza dove cadrà. Con le particelle non funziona così: non possiamo più dire, prima di effettuare una misura, dove è una particella, né possiamo sapere in anticipo quale sarà la sua traiettoria. Possiamo solo conoscere la probabilità di misurarla in un punto a una certa velocità.
Come è fatto un atomo?
La funzione d’onda è lo strumento giusto per studiare la struttura degli atomi. Prima però chiariamoci le idee: cos’è un atomo? Prima che fossero scoperte le particelle elementari si credeva che la materia fosse costituita da piccoli granelli chiamati atomi (àtomos = indivisibile). È effettivamente così. La materia è composta di atomi che differiscono tra loro per dimensione, forma e altre proprietà fisiche e che possono combinarsi per creare molecole e dunque diversi materiali. Però non sono veramente indivisibili, anzi. Un atomo è formato da tre tipi di particelle: protoni, neutroni e elettroni. I protoni hanno carica elettrica positiva, i neutroni non hanno carica elettrica e gli elettroni – che sono 1836 volte più leggeri dei protoni e molto più piccoli – hanno carica elettrica negativa. Agli inizi del Novecento i fisici credevano che i protoni (rossi, in figura) se ne stessero insieme ai neutroni (verdi) a formare il nucleo atomico – la parte centrale dell’atomo – e che gli elettroni (gialli) ruotassero intorno al nucleo un po’ come i pianeti ruotano attorno al Sole.
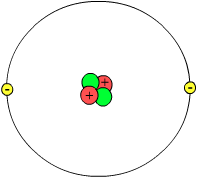
(Credit: Wikimedia Commons, CC BY-SA 3.0)
Questo schema non nasce a caso – la legge di Coulomb che regola l’attrazione tra cariche elettriche negative e positive è molto simile alla legge di gravitazione universale di Newton, che modella l’attrazione dei corpi celesti – e ha permesso di spiegare come è formata la materia.
Atomi con un numero equivalente di protoni, neutroni e elettroni sono atomi dello stesso elemento. Ad esempio gli atomi composti da 3 protoni, 4 neutroni e 3 elettroni sono atomi di litio, quella sostanza usata nelle batterie. Solitamente protoni e elettroni sono presenti nell’atomo in numero uguale e cambiando il numero di protoni, cambia l’elemento: l’idrogeno ha 1 protone, l’elio ne ha 2, con 8 si fa l’ossigeno, con 26 il ferro e così via. Cambiando il numero dei neutroni invece si formano i cosiddetti isotopi, ossia atomi dello stesso elemento ma con caratteristiche fisiche un po’ diverse. Per dire, il trizio è un isotopo dell’idrogeno che si ottiene aggiungendo due neutroni al nucleo dell’idrogeno. Ed è radioattivo.
Tuttavia i fisici hanno scoperto che gli atomi non possono essere fatti come un piccolo sistema solare – con il nucleo al centro e gli elettroni che orbitano intorno. Le leggi dell’elettromagnetismo di Maxwell infatti dicono che delle cariche elettriche che si muovono emettono energia sotto forma di onde elettromagnetiche. Gli elettroni quindi, ruotando come piccoli pianeti, dovrebbero emettere onde elettromagnetiche, perdere energia e, prima o poi, cadere sul nucleo atomico distruggendo l’atomo. Perché non accade?
Gli orbitali atomici
Non accade perché gli elettroni sono particelle che obbediscono alle leggi della Meccanica quantistica e non seguono una traiettoria come l’orbita circolare disegnata sopra. Se seguissero una traiettoria precisa, esisterebbe una formula matematica che predice dove si trova ogni elettrone e a che velocità sta viaggiando. Pensateci: studiando le orbite dei pianeti intorno al Sole, o dei satelliti attorno alla Terra, siamo in grado di calcolare dove si trovano e la loro velocità. Sappiamo però che, a causa del principio di indeterminazione di Heisenberg, non è possibile fare lo stesso per le particelle. L’idea stessa di orbita, quindi, non si può applicare al modello atomico: gli elettroni non seguono delle orbite ruotando attorno ai protoni e ai neutroni.
Eppure gli esperimenti hanno dimostrato che l’atomo è formato da due regioni, una più centrale e densa, fatta di protoni e neutroni, e una più esterna e diradata, in cui si trovano gli elettroni.
Per riuscire a descrivere questa struttura possiamo provare a studiare la funzione d’onda degli elettroni che si trovano attorno al nucleo, individuando quelle zone in cui è più probabile trovare gli elettroni, quando li cerchiamo. Le zone adiacenti al nucleo in cui è più probabile trovare gli elettroni sono chiamate orbitali atomici. Si chiamano così perché sostituiscono l’idea di orbita – non più utilizzabile.
L’orbitale dell’atomo più piccolo – l’idrogeno, che ha 1 protone, 1 elettrone e zero neutroni – è molto semplice: è una sfera che avvolge il nucleo atomico
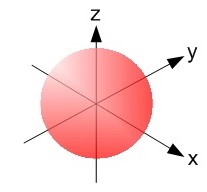
(Credit: Av haade – Own work, CC BY-SA 3.0)
e ci dice che in quella zona è c’è un alta probabilità di trovare l’elettrone dell’idrogeno. Per convenzione gli orbitali sono quelle aree in cui la probabilità di trovare l’elettrone è superiore al 95%. Significa quindi che l’elettrone potrebbe trovarsi anche fuori da quella zona, ma con una probabilità sempre più bassa man mano che ci si allontana.
L’idrogeno però ha una struttura molto semplice, perché ha un solo elettrone che ruota attorno a un protone.
Come si dispongono gli elettroni, quando sono più di uno?
Il principio di esclusione di Pauli
Le particelle, oltre ad avere una posizione, una velocità o una carica elettrica, possono avere anche altre proprietà fisiche. Una di queste è chiamata spin. Non ne parliamo oggi, perché è una cosa piuttosto complicata da spiegare, ma è importante citarlo perché anche gli elettroni hanno uno spin, che può assumere due valori: +1/2 o -1/2 (Non fate caso ai numeri o al loro significato). La cosa importante da sapere è che due elettroni con lo stesso spin non possono stare nello stesso orbitale. È una legge dettata dalla natura, conosciuta come principio di esclusione di Pauli: se in un orbitale c’è un elettrone con spin +1/2 e ce ne è un altro, quest’altro ha per forza spin -1/2. Quindi in un orbitale ci possono essere al massimo due elettroni.
Se attorno a un atomo ci sono più di due elettroni, questi si trovano per forza in orbitali diversi.
Esistono infatti molti tipi di orbitali, che vengono riempiti dagli elettroni seguendo un ordine particolare. I primi orbitali hanno queste forme strane.
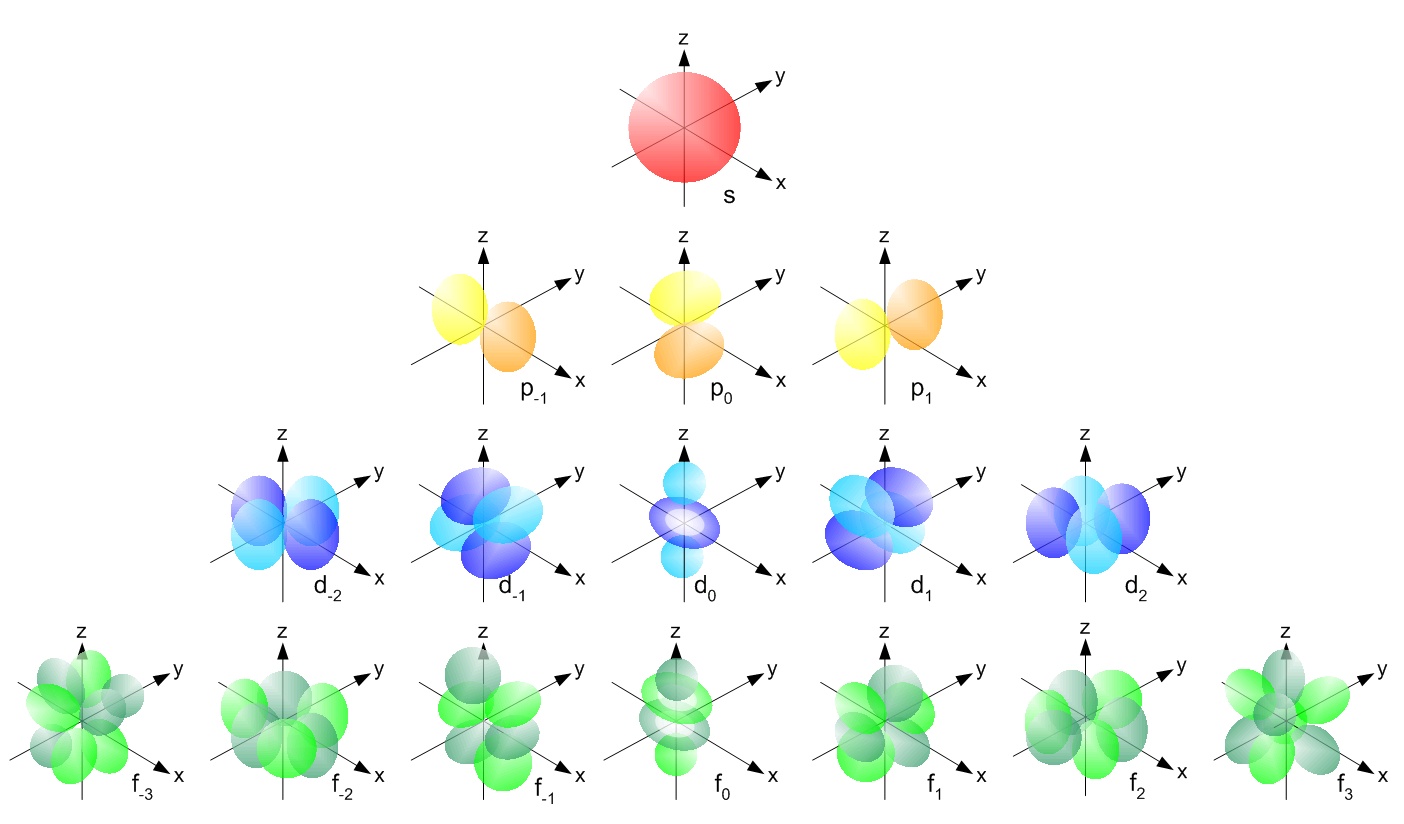
(Credit: Av haade – Own work, based on various sources, sketch NOT computer generated models, CC BY-SA 3.0)
Il primo orbitale a riempirsi è quello rosso, chiamato orbitale s, poi si riempiono gli orbitali gialli, detti p, poi quelli azzurri e così via. Per chi volesse approfondire la struttura atomica, gli orbitali e scoprire cosa sono i livelli energetici, lascio un link negli approfondimenti.
I legami chimici
Una cosa importante degli orbitali è che questi giocano un ruolo di primo piano nella formazione dei legami chimici tra gli atomi. Gli orbitali più esterni di due atomi, infatti, possono legarsi tra loro, mettendo in comune i loro elettroni. In questo caso nascono dei nuovi tipi di orbitali, chiamati orbitali molecolari. Non entriamo nel dettaglio. Chi è appassionato di chimica, trova un link negli approfondimenti.
Pillole della settimana
Alcune notizie di questi giorni, brevi.
Uno strano segnale forse proveniente dai buchi neri
Il 14 Settembre 2015, il Fermi Telescope della NASA ha misurato un lieve segnale proveniente dalla stessa regione di spazio da cui proveniva l’onda gravitazionale misurata da LIGO. Si tratta di un’emissione di raggi gamma ed è stata misurata meno di mezzo secondo dopo la rivelazione di LIGO. Potrebbe trattarsi di una coincidenza, anche se le probabilità che due segnali così importanti arrivino in un tempo così ravvicinato per puro caso è inferiore allo 0.2%. Nel breve video qui sotto è stata ricostruita la regione da cui provengono i due segnali. Questa misurazione potrebbe permetterci di capire meglio come funziona la fusione tra due buchi neri, ma soprattutto ci dimostra quanto è importante la triangolazione dei segnali. Per individuare l’esatta posizione di una sorgente di onde gravitazionali bisogna effettuare una triangolazione. Per fare una triangolazione servono tre “antenne”. Oggi ne abbiamo due – i due LIGO negli Stati Uniti. Quando anche Virgo, il rivelatore italiano, sarà attivo, sarà possibile localizzare nel giro di alcuni minuti l’origine delle onde gravitazionali e puntare tutti gli altri telescopi verso quel punto, per misurare altri tipi di radiazioni.
I punti luminosi di Ceres
La sonda Dawn, lanciata dalla NASA per raggiungere il pianeta nano Ceres e l’asteroide Vesta aveva individuato su Ceres dei punti molto luminosi, forse composti di ghiaccio esposto alla luce del sole. Non abbiamo ancora una risposta definitiva, ma nel frattempo abbiamo immagini di qualità sempre migliore, come questa immagine del cratere Haulani, ripreso da un’altitudine di 1470 km (i colori di questa foto non sono reali, ma evidenziano materiali di origine diversa. Si ingrandisce cliccando).

(Credit: Dawn/NASA)
Installato il modulo BEAM
Dopo essere stato lanciato con il Falcon 9, il modulo gonfiabile BEAM è stato installato con successo sulla Stazione Spaziale Internazionale. Il video dell’installazione si trova qui.
Analizzata della polvere interstellare
La sonda Cassini, realizzata dalla NASA con la collaborazione dell’Agenzia Spaziale Italiana, si trova in orbita intorno a Saturno. Cassini è dotata di uno strumento chiamato Cosmic Dust Analyzer, in grado di analizzare minuscoli granelli di polvere spaziale. Queste analisi hanno individuato per la prima volta delle polveri provenienti dall’esterno del Sistema Solare. Tutti i dettagli qui.
Feedback
Se vi piace la newsletter potete inoltrarla a un amico o suggerirgli di iscriversi.
Per scrivermi, mandate una mail a spacebreak [at] francescobussola.it
Per approfondire
– Il modello atomico a orbitali, spiegato con qualche dettaglio in più
– Gli orbitali molecolari

