L’entanglement
Se ve lo siete chiesti, no, la newsletter non è sparita. Ho dovuto metterla in pausa inaspettatamente e riesco a riprenderla solo oggi. Detto questo, ringrazio chi in queste settimane si è iscritto sulla fiducia, magari dimenticandosi di averlo fatto. Impavidi.
Prima, però, ecco la seconda puntata del podcast Storie, in cui intervisto giovani ricercatori in fisica. È la volta di Fabrizio Larcher, che si occupa di fisica dei fluidi ultrafreddi all’università di Trento. Lo trovate qui.
Ascolta 2. I fluidi ultrafreddi” su Spreaker.
Oggi parliamo dell’entanglement, che è forse uno dei fenomeni più esotici e controintuitivi della fisica moderna, tanto che anche i fisici rischiano di fare confusione quando ne parlano. Cercherò di fare del mio meglio.
In fondo alla newsletter trovate la vignetta di Ale.
Se avete domande scrivetemi a spacebreak [at] francescobussola.it.
Potete seguirmi su facebook e twitter.
Di cosa parliamo oggi
– i sistemi quantistici
– il problema della misura
– l’entanglement
– pillole
L’entanglement
Nella scorsa newsletter, così come in altre occasioni, abbiamo avuto modo di ricordare che le particelle in natura non si comportano sempre come delle “palline”, ma spesso hanno un comportamento simile alle onde: riescono a superare parzialmente gli ostacoli (effetto tunnel), attraversano due fessure contemporaneamente e non possiamo determinare contemporaneamente la loro posizione e la loro velocità, così come faremmo con una biglia. Della loro natura i fisici riescono a dare solo una descrizione probabilistica. Ad esempio: qual è la probabilità che, provando a misurare una particella in una certa posizione, la trovi esattamente lì?
Questo accade non tanto per l’incapacità dei fisici di essere più precisi con i loro esperimenti, ma apparentemente per un limite intrinseco della natura, che a scale microscopiche comincia a comportarsi in maniera strana.
In termini fisici questo concetto si traduce così: le particelle non si trovano quasi mai in un preciso stato fisico, ben definito. Molto spesso sono in una sovrapposizione di stati.
In altre parole, non è colpa nostra se non riusciamo a dire a priori dove si trova una particella, perché, quando si comporta come un’onda, si trova un po’ qui e un po’ là con una certa probabilità. Fortunatamente riusciamo a codificare questa e altre informazioni probabilistiche in un oggetto matematico chiamato funzione d’onda.
Se vi ricordate questa newsletter, è proprio questo comportamento ondulatorio che permette a una particella di passare attraverso due fessure contemporaneamente. Non mi dilungo: ne abbiamo già parlato qui, qui, qui, qui e qui.
I sistemi quantistici e la misura
Un sistema quantistico è un insieme di particelle, descritte appunto da una funzione d’onda. Come già detto, di loro non possiamo sapere tutto a priori: possiamo preparare queste particelle affinché abbiano una certa energia o siano confinate in una scatola, ma per conoscere alcune loro caratteristiche, le dobbiamo misurare.
Misurare una quantità fisica sembra un’operazione piuttosto semplice, se si trascurano gli errori di misurazione. Pensateci, se state guardando la Formula 1 potete conoscere la posizione e la velocità di ogni macchina quando volete. È facile misurarle.
Le cose si fanno più complicate però quando stiamo studiando delle particelle, che seguono le leggi della Meccanica quantistica. Supponiamo di voler misurare la posizione di una particella confinata in una scatola. Prima di misurarla sappiamo solo che la particella, che si sta comportando come un’onda, non si trova in un luogo preciso della scatola: si trova in una sovrapposizione di stati. È un po’ qui e un po’ là, con una certa probabilità. Si dice in questo caso che la sua funzione d’onda è delocalizzata, perché la particella non è precisamente in alcun luogo. Effettuando la misura, ossia misurando la posizione della particella, la sua funzione d’onda cambia, collassando in un punto preciso della scatola e la particella non si trova più in una sovrapposizione di stati, ma nello stato fisico che localizzato esattamente quel punto.
Sembra un meccanismo complicato e in fondo lo è, perché è molto controintuitivo, ma è fatto di tre semplici passaggi:
1. Prima di misurare la posizione della particella, sappiamo che è delocalizzata, perché si sta comportando come un’onda;
2. Al momento della misura, la funzione d’onda che descriveva la sovrapposizione dei luoghi in cui si trovava, collassa nel punto dove è stata misurata la particella;
3. Effettuata la misura, la particella non si comporta più come un’onda delocalizzata e la sua funzione d’onda non è più una sovrapposizione di stati.
La stessa cosa accade quando volete misurare una qualsiasi altra caratteristica delle particelle, come ad esempio la velocità o lo spin
Cos’è l’entanglement
L’entanglement è forse il fenomeno fisico più controintuitivo della fisica moderna. Ve lo spiego brevemente.
Immaginate di prendere un sistema quantistico formato da due particelle, ad esempio due elettroni, e cerchiamo di preparare questi elettroni affinché si trovino nello stesso stato fisico o, detto più grezzamente, affinché abbiano la stessa energia e la stessa funzione d’onda che ne descriva posizione e velocità. Sappiamo poi che gli elettroni hanno anche un’altra caratteristica fisica, chiamata spin. Ne abbiamo parlato in questa newsletter, ma non è fondamentale ora sapere cosa sia lo spin. Basta sapere che il valore dello spin degli elettroni è 1/2 e che può essere orientato in due direzioni: “su” o “giù”. Quindi un elettrone può avere spin 1/2 su oppure spin 1/2 giù. Altra cosa importante da ricordare è che, come dice il principio di esclusione di Pauli, se due elettroni si trovano nello stesso stato fisico, ossia se sono descritti dalla stessa funzione d’onda, non possono avere entrambi spin su o spin giù, ma devono alternarsi. È una regola della natura.
Ecco, nel nostro esperimento abbiamo preparato due elettroni nello stesso stato fisico e quindi, se uno di questi ha spin su, l’altro avrà spin giù e viceversa. Tuttavia non possiamo sapere quale dei due è su e quale è giù, perché, secondo la Meccanica quantistica questi elettroni si stanno comportando come onde e il loro spin è ora in una sovrapposizione di stati “su” e “giù” (un po’ come il gatto di Schroedinger nella scatola è sia vivo che morto contemporaneamente).
Ora per concludere l’esperimento, immaginate di separare questi due elettroni, trasportandoli in due luoghi molto distanti tra loro.
Ad esempio portiamone uno a Roma e uno a Tokyo. Gli elettroni, pur essendo separati, si trovano ancora nello stesso stato fisico di partenza: hanno una certa energia, una certa funzione d’onda che ne descrive la posizione e la velocità e il loro spin è ancora un miscuglio indefinito di “su” e “giù”.
Immaginate ora che i fisici di Roma provino a misurare lo spin dell’elettrone che hanno a disposizione e che trovino che il suo spin è 1/2 su.
Ecco,siccome l’altro elettrone ha la stessa funzione d’onda, a causa del principio di esclusione di Pauli, istantaneamente si modificherà in modo da avere spin 1/2 giù. Il comportamento dell’elettrone a Tokyo è dunque correlato a quello di Roma: se misuriamo qualche caratteristica fisica dell’elettrone di Roma, modificandone il suo stato e quindi la sua funzione d’onda, influenziamo anche le caratteristiche fisiche dell’elettrone di Tokyo e viceversa. Questa particolare correlazione si chiama appunto entanglement.
I problemi dell’entanglement
Questo strano fenomeno naturale sarebbe già affascinante così, se non creasse anche degli enormi problemi.
Il primo e più importante problema è questo: come fa l’elettrone di Tokyo a sapere istantaneamente che i fisici di Roma hanno misurato lo spin e che hanno trovato spin su?
Questa domanda è molto profonda. Da una parte indaga l’essenza stessa dell’entanglement: al momento della misura viene trasferita informazione da un elettrone all’altro? E se è così, possiamo usare l’entanglement per creare un moderno ed efficientissimo telegrafo senza fili, trasmettendo istantaneamente dei segnali da una parte all’altra del globo?
D’altra parte sorge un grosso problema concettuale: un’altra grande teoria fisica, la teoria della relatività, dice che nulla, compresi i segnali, può viaggiare più velocemente della luce. Significa quindi che abbiamo trovato un controesempio? Non sarà forse che il limite della velocità della luce è sbagliato?
Ne parliamo nella prossima newsletter.
Pillole
Alcune notizie di questi giorni, brevi.
La materia oscura non si vede
Gli scienziati ritengono che l’84% della materia presente nell’universo sia materia oscura. Uno dei modelli più gettonati sostiene che la materia oscura sia fatta da particelle dotate di massa, ma debolmente interagenti, chiamate WIMP. La collaborazione internazionale LUX (Large Underground Xenon) ha cercato di rivelare questo ipotetico tipo di particella, ma l’esperimento non ha dato i risultati sperati.
SpaceX
Avete presente il razzo Falcon9 di SpaceX, quello che atterra in verticale su una chiatta? Questa foto rende bene l’idea di quanto sia grande.

Kepler trova pianeti
Grazie ai dati raccolti dalla missione Kepler, lanciata dalla NASA nel 2009, un gruppo di ricerca della Harvard university ha classificato gli esopianeti individuati dal telescopio suddividendoli in quattro gruppi in base alla loro grandezza e al loro grado di abitabilità. La ricerca di pianeti potenzialmente simili alla Terra al di fuori del Sistema solare continua.
La fisica di Ale
La striscia di oggi. I fumetti di Alessandro sono su Vuoto Comico.
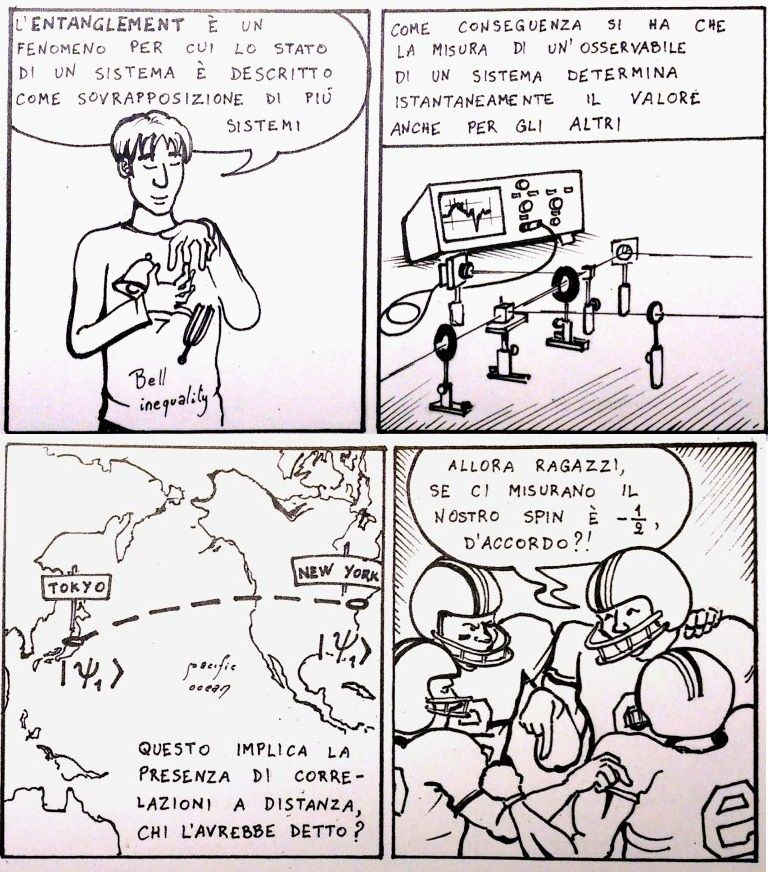
[Credit: L’entanglement, di Alessandro Toffali (Vuoto Comico), CC-BY-NC-ND 4.0]
Per approfondire
– Un articolo su Wired, in italiano
– Un articolo su Vice, in italiano
– Un video con le vignette di PhD comics, in inglese
– Un video di TED, con i sottotitoli in italiano
Che cos’è lo spin
La fisica si occupa di studiare alcune grandezze che possono essere misurate, come ad esempio la velocità o la posizione di un corpo. Una di queste è lo spin, una proprietà legata alla Meccanica quantistica.
Oltre a questo oggi parliamo di Hawking, tanto per cambiare, e della ricerca sulle tecnologie quantistiche.Se ti piace la newsletter puoi suggerire ai tuoi amici di iscriversi e invitarli a mettere mi piace sulla pagina facebook, dove ogni tanto pubblico degli approfondimenti e dei video. Space break ha anche un account twitter.
Potete contattarmi rispondendo a questa mail o scrivendo a spacebreak [at] francescobussola.it. È uguale.
Di cosa parliamo oggi
– la fisica e le quantità osservabili
– lo spin
– bosoni e fermioni
– pillole della settimana
La fisica e le quantità osservabili
Ci sono varie discipline che cercano di dare delle spiegazioni sulla natura delle cose. La fisica, la filosofia e la teologia sono tra queste. A differenza delle altre, però, la fisica si occupa di studiare e misurare delle quantità. La domanda ultima dei fisici non è infatti perché le cose accadono, ma come. Si sviluppa una teoria che predice dei risultati e si confrontano questi risultati con gli esperimenti. Ciò che differenzia la fisica dalle altre discipline è dunque il concetto di falsificabilità: se il risultato è compatibile con gli esperimenti, la teoria è buona, altrimenti c’è qualcosa da sistemare.
Esistono quindi in fisica delle quantità più importanti di altre, dette osservabili. Sono le quantità che possiamo misurare.
Alcune osservabili le conosciamo tutti: la velocità di un corpo o la sua posizione, ad esempio. In Meccanica quantistica – quella teoria fisica che si occupa dell’infinitamente piccolo – le osservabili hanno una descrizione matematica piuttosto complicata e obbediscono a delle leggi un po’ controintuitive, come ad esempio il principio di indeterminazione di Heisenberg (di cui abbiamo parlato). Inoltre predice l’esistenza di alcune osservabili che la Meccanica classica – quella di Galileo e Newton – non prevedeva. Una di queste è lo spin.
Lo spin
Nelle scorse newsletter abbiamo detto che lo stato fisico di una particella – ossia l’insieme delle sue proprietà fisiche, come la velocità, la posizione e così via – è descritto dalla Meccanica quantistica attraverso un oggetto matematico chiamato funzione d’onda. Non mi dilungo nella spiegazione perché ne abbiamo parlato più volte – qui, qui e qui. Abbiamo anche visto la settimana scorsa che le particelle, oltre ad avere una posizione, una velocità o una carica elettrica, possono avere altre proprietà fisiche e che una di queste è chiamata appunto spin.
Lo spin è importante perché influenza il comportamento di alcune particelle. In un atomo, ad esempio, due elettroni con lo stesso spin non possono avere la stessa funzione d’onda. Questo legge, chiamata principio di esclusione di Pauli, determina direttamente la struttura degli atomi e dunque le proprietà della materia. Ma cos’è lo spin?
Lo spin, semplificando troppo
Immaginiamo un pianeta che ruota su se stesso, come una trottola. Si dice in fisica che questo pianeta ha un momento angolare. Il momento angolare è una quantità che descrive la rotazione di un corpo. Quanti giri deve fare il pianeta prima di mostrare nuovamente la sua faccia iniziale? Uno. Dopo un giro, ossia dopo una rotazione di 360°, il pianeta torna nella posizione di partenza.
Lo spin è una proprietà fisica delle particelle simile al momento angolare. Se il pianeta fosse una particella e stessimo parlando del suo spin, diremmo che il pianeta ha spin 1: dopo 360° ha mostrato nuovamente il suo volto iniziale.
Prendiamo ora, al posto di un pianeta, una moneta con entrambe le facce uguali. Di quanti gradi bisogna ruotarla perché torni nella sua posizione di partenza? Se le due facce sono indistinguibili, basta ruotarla di mezzo giro, ossia di 180°, per riportarla nella posizione iniziale. Se la moneta fosse una particella e stessimo parlando del suo spin, diremmo che la moneta ha spin 2: dopo 180° (=360°/2) ha mostrato il suo volto iniziale.
Lo spin, per i coraggiosi
Però lo spin non ci dice come ruotano le particelle. Per descrivere la rotazione delle particelle abbiamo già una quantità fisica – il momento angolare, appunto. Paragonare lo spin a una quantità classica come il momento angolare è una semplificazione fuorviante.
Esistono infatti particelle che hanno spin 1/2 – come gli elettroni – o spin 3/2, 5/2 e così via. Usando la metafora di prima, una particella con spin 1/2 dovrebbe fare due giri prima di tornare nella posizione di partenza. Chiaramente, detta così, non ha molto senso: l’analogia con il momento angolare non torna.
Purtroppo non c’è un modo per spiegare in maniera approfondita lo spin senza utilizzare la matematica e il formalismo della Meccanica quantistica.
È però interessante notare che lo spin è legato alle proprietà magnetiche delle particelle. Immaginate ogni particella come una piccola calamita, con un polo nord e un polo sud. In un certo senso lo spin ci dice la direzione e l’intensità di questa calamita.
È proprio questa idea che viene sfruttata quando facciamo una risonanza magnetica in ospedale. La risonanza magnetica funziona grossomodo così. Il nostro corpo viene messo dentro un grande magnete. Le particelle che compongono il nostro corpo sentono il campo magnetico creato dal magnete e, come tante piccole calamite, allineano il loro spin nella direzione del magnete, un po’ come fa l’ago della bussola quando si allinea al campo magnetico della Terra. Quando poi il magnete viene spento, gli spin ritornano nella posizione originale, rilasciando dell’energia. Questa energia può essere misurata e, siccome ogni particella rilascia un’energia diversa, è possibile ricreare un’immagine dei nostri organi interni.
Bosoni e fermioni
Quando abbiamo parlato del Modello standard delle particelle, abbiamo detto che le particelle elementari si dividono in due grandi gruppi: i bosoni e i fermioni.
Ciò che suddivide le particelle in queste due grandi famiglie è proprio lo spin. Tutte le particelle che hanno spin intero, ossia quelle con spin 0, 1, 2, 3 e così via sono bosoni. Tutte le particelle con spin semintero, ossia con spin 1/2 (come gli elettroni), 3/2, 5/2 e così via sono fermioni. Bosoni e fermioni hanno caratteristiche molto diverse. I fermioni, ad esempio – che seguono una legge statistica chiamata statistica di Fermi – rispettano il principio di esclusione di Pauli, mentre i bosoni – che seguono la statistica di Bose-Einstein – no. Questa differenza ha conseguenze importanti sul comportamento delle particelle e su come interagiscono tra loro.
Pillole della settimana
Alcune notizie di questi giorni, brevi.
Hawking vicino al Nobel?
Alcune testate giornalistiche italiane, citando come fonte il Times, riportano la notizia che Hawking sarebbe vicino al premio Nobel. Hawking è famoso principalmente per aver predetto l’esistenza della radiazione di Hawking, una radiazione termica emessa dai buchi neri. Il Nobel sarebbe giustificato dal fatto che un gruppo di ricerca israeliano, guidato dal fisico Jeff Steinhauer, avrebbe dimostrato la predizione teorica di Hawking creando “un buco nero da laboratorio”. Direi di andarci cauti. Leggendo l’articolo di Steinhauer ci si rende conto – come era prevedibile – che l’esperimento non riguarda i buchi neri. Si tratta – per chi sa cos’è – di un condensato di Bose-Einstein, confinato da dei laser, che modella il comportamento di un buco nero. In sostanza è un modellino, un sistema che si comporta in maniera analoga ai buchi neri. Le analogie in fisica sono sempre interessanti, ma non è detto che ciò che vale per il modellino, valga anche per i buchi neri.
L’UE stanzierà 1 miliardo di euro per le tecnologie quantistiche
La Commissione UE stanzierà, a partire dal 2018, 1 miliardo di euro per accelerare la ricerca sulle tecnologie quantistiche. Il programma di ricerca e sviluppo, proposto da Tommaso Calarco – presidente del Comitato strategico europeo per le tecnologie quantistiche e direttore del centro di Scienza e Tecnologia Quantistica delle università di Ulm e Stoccarda – potrebbe avere nei prossimi anni un ampio spettro di ricadute tecnologiche e industriali.
Per approfondire
– Lo spin e la risonanza magnetica (con formule)
– Un video brevissimo in inglese sulla risonanza magnetica
– I condensati di Bose-Einstein in Italia
Gli orbitali atomici
Gli elettroni sono distribuiti attorno al nucleo degli atomi seguendo le leggi della Meccanica quantistica, in alcune aree chiamate orbitali atomici. È l’argomento di oggi.
Per il resto parleremo di una novità riguardante le onde gravitazionali, dei famosi punti luminosi di Ceres – il pianeta nano – e di altre notizie della settimana.
Di cosa parliamo oggi
– la funzione d’onda
– come è fatto un atomo?
– gli orbitali atomici
– pillole della settimana
La funzione d’onda
Parlando della Meccanica quantistica avevamo detto che non è possibile misurare contemporaneamente la posizione e la velocità delle particelle con precisione arbitraria. Meglio misuriamo la posizione di una particella, più incerta è la misura della sua velocità e viceversa. Non è un limite sperimentale, ma un confine dato alla nostra conoscenza dalla natura e viene chiamato principio di indeterminazione di Heisenberg (per chi si è perso e per chi non c’era, ne abbiamo parlato qui). Per questo in Meccanica quantistica viene usata una descrizione probabilistica dello stato fisico delle particelle: la funzione d’onda. La funzione d’onda ci dice qual è la probabilità di trovare una certa particella in un determinato stato fisico – ad esempio qual è la probabilità di trovarla in una certa posizione. Questa descrizione probabilistica del comportamento delle particelle ha avuto molto successo, anche se ci ha costretto a cambiare modo di pensare. Se mettiamo una pallina sul tavolo e usciamo dalla stanza, possiamo dire con certezza che la pallina è rimasta sul tavolo. Se poi la lanciamo per aria, possiamo calcolare il suo moto e predire con esattezza dove cadrà. Con le particelle non funziona così: non possiamo più dire, prima di effettuare una misura, dove è una particella, né possiamo sapere in anticipo quale sarà la sua traiettoria. Possiamo solo conoscere la probabilità di misurarla in un punto a una certa velocità.
Come è fatto un atomo?
La funzione d’onda è lo strumento giusto per studiare la struttura degli atomi. Prima però chiariamoci le idee: cos’è un atomo? Prima che fossero scoperte le particelle elementari si credeva che la materia fosse costituita da piccoli granelli chiamati atomi (àtomos = indivisibile). È effettivamente così. La materia è composta di atomi che differiscono tra loro per dimensione, forma e altre proprietà fisiche e che possono combinarsi per creare molecole e dunque diversi materiali. Però non sono veramente indivisibili, anzi. Un atomo è formato da tre tipi di particelle: protoni, neutroni e elettroni. I protoni hanno carica elettrica positiva, i neutroni non hanno carica elettrica e gli elettroni – che sono 1836 volte più leggeri dei protoni e molto più piccoli – hanno carica elettrica negativa. Agli inizi del Novecento i fisici credevano che i protoni (rossi, in figura) se ne stessero insieme ai neutroni (verdi) a formare il nucleo atomico – la parte centrale dell’atomo – e che gli elettroni (gialli) ruotassero intorno al nucleo un po’ come i pianeti ruotano attorno al Sole.
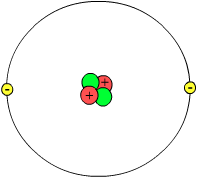
(Credit: Wikimedia Commons, CC BY-SA 3.0)
Questo schema non nasce a caso – la legge di Coulomb che regola l’attrazione tra cariche elettriche negative e positive è molto simile alla legge di gravitazione universale di Newton, che modella l’attrazione dei corpi celesti – e ha permesso di spiegare come è formata la materia.
Atomi con un numero equivalente di protoni, neutroni e elettroni sono atomi dello stesso elemento. Ad esempio gli atomi composti da 3 protoni, 4 neutroni e 3 elettroni sono atomi di litio, quella sostanza usata nelle batterie. Solitamente protoni e elettroni sono presenti nell’atomo in numero uguale e cambiando il numero di protoni, cambia l’elemento: l’idrogeno ha 1 protone, l’elio ne ha 2, con 8 si fa l’ossigeno, con 26 il ferro e così via. Cambiando il numero dei neutroni invece si formano i cosiddetti isotopi, ossia atomi dello stesso elemento ma con caratteristiche fisiche un po’ diverse. Per dire, il trizio è un isotopo dell’idrogeno che si ottiene aggiungendo due neutroni al nucleo dell’idrogeno. Ed è radioattivo.
Tuttavia i fisici hanno scoperto che gli atomi non possono essere fatti come un piccolo sistema solare – con il nucleo al centro e gli elettroni che orbitano intorno. Le leggi dell’elettromagnetismo di Maxwell infatti dicono che delle cariche elettriche che si muovono emettono energia sotto forma di onde elettromagnetiche. Gli elettroni quindi, ruotando come piccoli pianeti, dovrebbero emettere onde elettromagnetiche, perdere energia e, prima o poi, cadere sul nucleo atomico distruggendo l’atomo. Perché non accade?
Gli orbitali atomici
Non accade perché gli elettroni sono particelle che obbediscono alle leggi della Meccanica quantistica e non seguono una traiettoria come l’orbita circolare disegnata sopra. Se seguissero una traiettoria precisa, esisterebbe una formula matematica che predice dove si trova ogni elettrone e a che velocità sta viaggiando. Pensateci: studiando le orbite dei pianeti intorno al Sole, o dei satelliti attorno alla Terra, siamo in grado di calcolare dove si trovano e la loro velocità. Sappiamo però che, a causa del principio di indeterminazione di Heisenberg, non è possibile fare lo stesso per le particelle. L’idea stessa di orbita, quindi, non si può applicare al modello atomico: gli elettroni non seguono delle orbite ruotando attorno ai protoni e ai neutroni.
Eppure gli esperimenti hanno dimostrato che l’atomo è formato da due regioni, una più centrale e densa, fatta di protoni e neutroni, e una più esterna e diradata, in cui si trovano gli elettroni.
Per riuscire a descrivere questa struttura possiamo provare a studiare la funzione d’onda degli elettroni che si trovano attorno al nucleo, individuando quelle zone in cui è più probabile trovare gli elettroni, quando li cerchiamo. Le zone adiacenti al nucleo in cui è più probabile trovare gli elettroni sono chiamate orbitali atomici. Si chiamano così perché sostituiscono l’idea di orbita – non più utilizzabile.
L’orbitale dell’atomo più piccolo – l’idrogeno, che ha 1 protone, 1 elettrone e zero neutroni – è molto semplice: è una sfera che avvolge il nucleo atomico
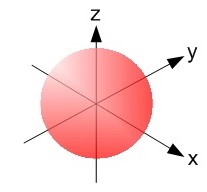
(Credit: Av haade – Own work, CC BY-SA 3.0)
e ci dice che in quella zona è c’è un alta probabilità di trovare l’elettrone dell’idrogeno. Per convenzione gli orbitali sono quelle aree in cui la probabilità di trovare l’elettrone è superiore al 95%. Significa quindi che l’elettrone potrebbe trovarsi anche fuori da quella zona, ma con una probabilità sempre più bassa man mano che ci si allontana.
L’idrogeno però ha una struttura molto semplice, perché ha un solo elettrone che ruota attorno a un protone.
Come si dispongono gli elettroni, quando sono più di uno?
Il principio di esclusione di Pauli
Le particelle, oltre ad avere una posizione, una velocità o una carica elettrica, possono avere anche altre proprietà fisiche. Una di queste è chiamata spin. Non ne parliamo oggi, perché è una cosa piuttosto complicata da spiegare, ma è importante citarlo perché anche gli elettroni hanno uno spin, che può assumere due valori: +1/2 o -1/2 (Non fate caso ai numeri o al loro significato). La cosa importante da sapere è che due elettroni con lo stesso spin non possono stare nello stesso orbitale. È una legge dettata dalla natura, conosciuta come principio di esclusione di Pauli: se in un orbitale c’è un elettrone con spin +1/2 e ce ne è un altro, quest’altro ha per forza spin -1/2. Quindi in un orbitale ci possono essere al massimo due elettroni.
Se attorno a un atomo ci sono più di due elettroni, questi si trovano per forza in orbitali diversi.
Esistono infatti molti tipi di orbitali, che vengono riempiti dagli elettroni seguendo un ordine particolare. I primi orbitali hanno queste forme strane.
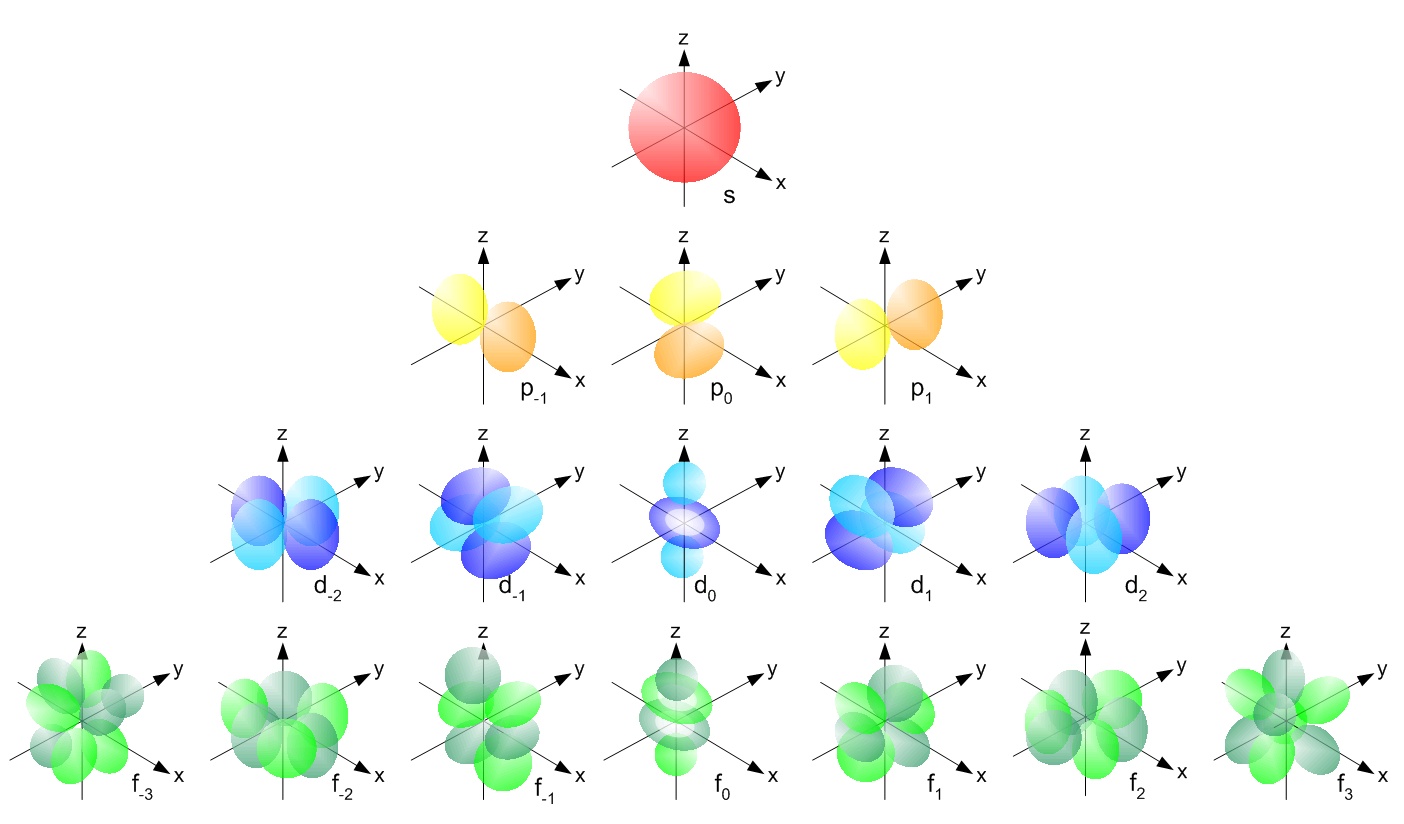
(Credit: Av haade – Own work, based on various sources, sketch NOT computer generated models, CC BY-SA 3.0)
Il primo orbitale a riempirsi è quello rosso, chiamato orbitale s, poi si riempiono gli orbitali gialli, detti p, poi quelli azzurri e così via. Per chi volesse approfondire la struttura atomica, gli orbitali e scoprire cosa sono i livelli energetici, lascio un link negli approfondimenti.
I legami chimici
Una cosa importante degli orbitali è che questi giocano un ruolo di primo piano nella formazione dei legami chimici tra gli atomi. Gli orbitali più esterni di due atomi, infatti, possono legarsi tra loro, mettendo in comune i loro elettroni. In questo caso nascono dei nuovi tipi di orbitali, chiamati orbitali molecolari. Non entriamo nel dettaglio. Chi è appassionato di chimica, trova un link negli approfondimenti.
Pillole della settimana
Alcune notizie di questi giorni, brevi.
Uno strano segnale forse proveniente dai buchi neri
Il 14 Settembre 2015, il Fermi Telescope della NASA ha misurato un lieve segnale proveniente dalla stessa regione di spazio da cui proveniva l’onda gravitazionale misurata da LIGO. Si tratta di un’emissione di raggi gamma ed è stata misurata meno di mezzo secondo dopo la rivelazione di LIGO. Potrebbe trattarsi di una coincidenza, anche se le probabilità che due segnali così importanti arrivino in un tempo così ravvicinato per puro caso è inferiore allo 0.2%. Nel breve video qui sotto è stata ricostruita la regione da cui provengono i due segnali. Questa misurazione potrebbe permetterci di capire meglio come funziona la fusione tra due buchi neri, ma soprattutto ci dimostra quanto è importante la triangolazione dei segnali. Per individuare l’esatta posizione di una sorgente di onde gravitazionali bisogna effettuare una triangolazione. Per fare una triangolazione servono tre “antenne”. Oggi ne abbiamo due – i due LIGO negli Stati Uniti. Quando anche Virgo, il rivelatore italiano, sarà attivo, sarà possibile localizzare nel giro di alcuni minuti l’origine delle onde gravitazionali e puntare tutti gli altri telescopi verso quel punto, per misurare altri tipi di radiazioni.
I punti luminosi di Ceres
La sonda Dawn, lanciata dalla NASA per raggiungere il pianeta nano Ceres e l’asteroide Vesta aveva individuato su Ceres dei punti molto luminosi, forse composti di ghiaccio esposto alla luce del sole. Non abbiamo ancora una risposta definitiva, ma nel frattempo abbiamo immagini di qualità sempre migliore, come questa immagine del cratere Haulani, ripreso da un’altitudine di 1470 km (i colori di questa foto non sono reali, ma evidenziano materiali di origine diversa. Si ingrandisce cliccando).

(Credit: Dawn/NASA)
Installato il modulo BEAM
Dopo essere stato lanciato con il Falcon 9, il modulo gonfiabile BEAM è stato installato con successo sulla Stazione Spaziale Internazionale. Il video dell’installazione si trova qui.
Analizzata della polvere interstellare
La sonda Cassini, realizzata dalla NASA con la collaborazione dell’Agenzia Spaziale Italiana, si trova in orbita intorno a Saturno. Cassini è dotata di uno strumento chiamato Cosmic Dust Analyzer, in grado di analizzare minuscoli granelli di polvere spaziale. Queste analisi hanno individuato per la prima volta delle polveri provenienti dall’esterno del Sistema Solare. Tutti i dettagli qui.
Feedback
Se vi piace la newsletter potete inoltrarla a un amico o suggerirgli di iscriversi.
Per scrivermi, mandate una mail a spacebreak [at] francescobussola.it
Per approfondire
– Il modello atomico a orbitali, spiegato con qualche dettaglio in più
– Gli orbitali molecolari



